راهنمای جامع علمی پرکاری، کمکاری و ندولهای تیروئید
مقدمه: نقش حیاتی غده تیروئید در سلامت بدن
غده تیروئید، اندامی پروانهای شکل که در جلوی گردن، زیر حنجره و روی نای قرار دارد، به عنوان یکی از مهمترین غدد درونریز بدن شناخته میشود. این غده با وزن تقریبی ۱۲ تا ۲۰ گرم، مسئول تولید و ترشح هورمونهای حیاتی تیروکسین (T_4) و ترییدوتیرونین (T_3) است که هر دو از یک خانواده شیمیایی هستند. این هورمونها نقش فرماندهی خاموش را در بدن ایفا میکنند و بر تقریباً تمام عملکردهای فیزیولوژیک از جمله تنظیم متابولیسم پایه، تولید انرژی در سلولها، و رشد و نمو اندامها تأثیر میگذارند. از دوران جنینی، تیروئید در تمایز یافتن سلولها و تشکیل اعضا نقشی حیاتی دارد و در بزرگسالی به حفظ هموستاز انرژی و متابولیک بدن کمک میکند. اختلال در عملکرد این غده میتواند منجر به دو وضعیت اصلی و متضاد شود: پرکاری تیروئید (هایپرتیروئیدیسم) که با افزایش تولید هورمون همراه است، و کمکاری تیروئید (هایپوتیروئیدیسم) که ناشی از کمبود هورمون است. همچنین، ندولهای تیروئید، به عنوان تودههای شایع در این غده، نگرانیهای متفاوتی را ایجاد میکنند که نیاز به ارزیابی دقیق دارند. این گزارش به بررسی عمیق فیزیولوژی، پاتوفیزیولوژی، علائم، تشخیص و رویکردهای درمانی این سه اختلال میپردازد.
بخش اول: فیزیولوژی بنیادین غده تیروئید
ساختار و سنتز هورمونها
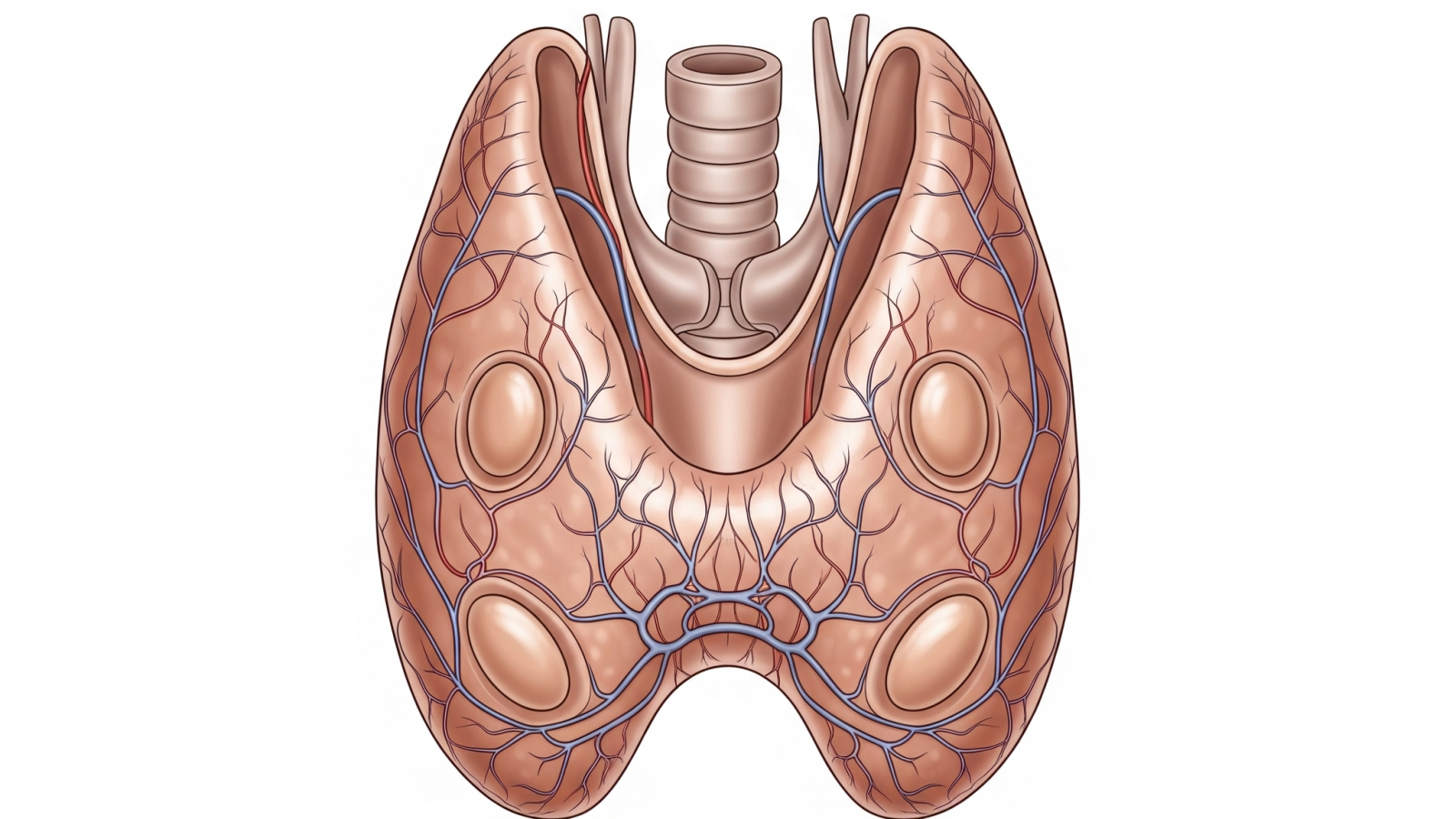
غده تیروئید از دو لوب تشکیل شده که توسط تنگهای (ایستموس) به یکدیگر متصل شدهاند. تولید هورمونهای تیروئید فرآیندی پیچیده است که با جذب ید از جریان خون آغاز میشود. ید به پروتئینی به نام تیروگلوبولین که در سلولهای فولیکولی تیروئید ساخته میشود، متصل میگردد تا ترکیبات مونویدوتیروزین (MIT) و دییدوتیروزین (DIT) را بسازد. سپس، دو مولکول DIT با هم ترکیب شده و هورمون T_4 را تشکیل میدهند، در حالی که یک مولکول MIT با یک مولکول DIT ترکیب میشود تا هورمون T_3 را ایجاد کند. هورمونهای ساخته شده در تیروگلوبولین ذخیره میشوند و در زمان نیاز از آن جدا شده و وارد جریان خون میگردند. هورمون T_4 دارای چهار اتم ید است و با حذف یک اتم ید به هورمون فعالتر T_3 تبدیل میشود. این هورمونها با تأثیر بر دو گیرنده آلفا و بتا در سلولهای بدن، وظایف متعددی از جمله تنظیم سرعت متابولیسم پایه، کنترل دمای بدن و تأثیر بر ضربان قلب و قدرت انقباض آن را بر عهده دارند.
مکانیسم کنترل مرکزی: محور هیپوتالاموس-هیپوفیز-تیروئید (HPT)
عملکرد غده تیروئید توسط یک سیستم نظارتی دقیق به نام محور هیپوتالاموس-هیپوفیز-تیروئید (HPT) کنترل میشود. این محور یکی از چهار سیستم عصبی-غددی اصلی است که هیپوتالاموس و هیپوفیز از طریق آنها عملکرد نورو-غددی خود را هدایت میکنند. در این سیستم، هیپوتالاموس هورمون آزادکننده تیروتروپین (TRH) را ترشح میکند که هیپوفیز قدامی را تحریک به تولید هورمون محرک تیروئید (TSH) میکند. TSH سپس غده تیروئید را وادار به تولید و ترشح هورمونهای T_4 و T_3 مینماید.
این سیستم مبتنی بر یک مکانیسم بازخورد منفی دقیق است؛ به این معنی که افزایش سطح هورمونهای T_4 و T_3 در خون، ترشح TSH از هیپوفیز را کاهش میدهد و برعکس. در نتیجه، سطح TSH به عنوان یک شاخص بسیار حساس برای عملکرد تیروئید عمل میکند. برای مثال، افزایش سطح TSH به همراه کاهش T_4 و T_3 نشاندهنده این است که هیپوفیز در حال تلاش برای تحریک تیروئید کمکار است (کمکاری اولیه تیروئید). در مقابل، کاهش TSH به همراه افزایش T_4 و T_3 بیانگر آن است که هیپوفیز در حال سرکوب فعالیت بیش از حد تیروئید است (پرکاری اولیه تیروئید).
با این حال، تفسیر نتایج آزمایشها نیازمند یک رویکرد جامعتر است. پایین بودن همزمان سطح TSH و FT4 میتواند ناشی از نارسایی غده هیپوفیز باشد که منجر به کمکاری تیروئید ثانویه میگردد. این وضعیت نشان میدهد که مشکل از خود غده تیروئید نیست، بلکه از غدد فرماندهی در مغز است. بنابراین، تشخیص دقیق بیماریهای تیروئید صرفاً با یک تست کافی نیست و پزشک با بررسی ترکیب نتایج TSH و FT4 و FT3 میتواند بین اختلالات اولیه و ثانویه تمایز قائل شود. این تمایز برای انتخاب روش درمانی صحیح و هدفمند حیاتی است.
بخش دوم: پرکاری تیروئید (هایپرتیروئیدیسم)
تعریف و علائم بالینی
پرکاری تیروئید به وضعیتی اطلاق میشود که غده تیروئید بیش از حد نیاز بدن هورمون تولید میکند. این افزایش تولید هورمون باعث افزایش سرعت متابولیسم بدن میشود و علائم متعددی را در پی دارد. علائم این بیماری بسته به شدت آن ممکن است متفاوت باشد و اغلب به تدریج ظاهر میشوند. این علائم شامل کاهش وزن ناگهانی، حتی با وجود افزایش اشتها، تعریق غیرعادی و عدم تحمل گرما، تپش قلب و ضربان قلب سریع و نامنظم (تاکیکاردی و آریتمی)، لرزش دستها و انگشتان، عصبانیت، اضطراب و تحریکپذیری، بیخوابی و مشکلات خواب، و ضعف عضلانی است. در برخی موارد، غده تیروئید بزرگ شده و منجر به ایجاد گواتر میگردد.
علل و پاتوفیزیولوژی
شایعترین علت پرکاری تیروئید، بیماری گریوز است که یک اختلال خودایمنی محسوب میشود. در این بیماری، سیستم ایمنی بدن به اشتباه به غده تیروئید حمله کرده و آن را به تولید بیش از حد هورمونها تحریک میکند. بیماری گریوز در ۶۰ تا ۸۰ درصد موارد علت اصلی پرکاری تیروئید است و اغلب زنان را در سنین ۳۰ تا ۵۰ سالگی تحت تأثیر قرار میدهد. علاوه بر این، ندولهای تیروئید نیز میتوانند منجر به پرکاری شوند. این ندولها ممکن است به صورت مستقل (اتونوموس) هورمون تولید کرده و باعث افزایش سطح هورمونهای تیروئید شوند که به آنها ندولهای سمی یا توکسیک نیز گفته میشود. التهاب غده تیروئید (تیروئیدیت) که باعث نشت هورمونهای ذخیرهشده میگردد، از دیگر دلایل پرکاری تیروئید است.
رویکردهای تشخیصی
تشخیص پرکاری تیروئید معمولاً با آزمایش خون آغاز میشود. الگوی کلاسیک پرکاری تیروئید شامل TSH پایین و T4 و/یا T3 بالا است. در صورت مشکوک بودن به علت خودایمنی مانند بیماری گریوز، پزشک ممکن است آزمایشهای آنتیبادی تیروئید مانند TRAb را تجویز کند. برای افتراق بین علل مختلف پرکاری، اسکن تیروئید با ید رادیواکتیو (RAIU) نیز میتواند مفید باشد؛ این تست میزان جذب ید توسط غده تیروئید را نشان میدهد.
گزینههای درمانی
درمان پرکاری تیروئید به علت بیماری و شدت آن بستگی دارد. گزینههای درمانی شامل موارد زیر است:
- داروهای آنتیتیروئید: داروهایی مانند متیمازول (تاپازول) و پروپیلتیواوراسیل (PTU) تولید هورمونهای تیروئید را مهار میکنند.
- درمان با ید رادیواکتیو (RAI): در این روش، بیمار مقدار کمی ید رادیواکتیو (^{131}I) به صورت خوراکی دریافت میکند که توسط سلولهای پرکار تیروئید جذب شده و به تدریج آنها را از بین میبرد. این درمان اغلب منجر به کمکاری دائمی تیروئید میشود که نیاز به مصرف مادامالعمر هورمون جایگزین دارد.
- جراحی (تیروئیدکتومی): این روش شامل برداشتن کامل یا بخشی از غده تیروئید است و یک راه حل قطعی برای درمان پرکاری تیروئید است. پس از جراحی کامل، بیمار باید تا آخر عمر از هورمونهای جایگزین استفاده کند.
- بتا-بلوکرها: داروهایی مانند پروپرانولول علائم مرتبط با افزایش ضربان قلب و لرزش را کنترل میکنند اما سطح هورمونها را تغییر نمیدهند. این داروها معمولاً به عنوان درمان کمکی برای مدیریت علائم موقت استفاده میشوند.
انتخاب روش درمانی برای پرکاری تیروئید تنها به بازگرداندن سطح هورمونها به حالت طبیعی محدود نمیشود. برای مثال، درمان با ید رادیواکتیو یا جراحی، اغلب منجر به یک وضعیت جدید یعنی کمکاری تیروئید میشود. این وضعیت اگرچه نیاز به مدیریت مادامالعمر با دارو دارد، اما مدیریت آن معمولاً سادهتر از پرکاری تیروئید است. بنابراین، تصمیمگیری برای درمان باید با در نظر گرفتن تمام جوانب و عواقب بلندمدت اتخاذ شود و بیمار باید از این چرخه درمانی آگاه باشد. این نگاه بلندمدت و جامع، پزشک و بیمار را قادر میسازد تا بهترین رویکرد درمانی را برای حفظ کیفیت زندگی انتخاب کنند.
بخش سوم: کمکاری تیروئید (هایپوتیروئیدیسم)
تعریف و علائم بالینی
کمکاری تیروئید زمانی اتفاق میافتد که غده تیروئید به اندازه کافی هورمون تولید نمیکند و در نتیجه سرعت متابولیسم بدن کند میشود. این بیماری در زنان سه برابر شایعتر از مردان است. علائم این بیماری به تدریج و در طول سالها ظاهر میشوند و ممکن است در مراحل اولیه خفیف باشند. شایعترین علائم شامل خستگی شدید، افزایش وزن بیدلیل، یبوست، افزایش حساسیت به سرما، خشکی پوست، نازک شدن موها، افسردگی و اختلال در حافظه است.
علل و پاتوفیزیولوژی
شایعترین علت کمکاری تیروئید در مناطق با دریافت ید کافی، بیماری هاشیموتو است. این بیماری یک اختلال خودایمنی است که در آن سیستم ایمنی بدن به غده تیروئید حمله کرده و باعث التهاب و تخریب تدریجی آن میشود. در نتیجه، توانایی غده برای تولید هورمون کاهش مییابد. سایر علل کمکاری تیروئید عبارتند از:
- کمبود ید: ید یک ماده شیمیایی ضروری برای سنتز هورمونهای تیروئید است و کمبود شدید آن میتواند منجر به کمکاری شود.
- عواقب درمان پرکاری: همانطور که اشاره شد، درمانهایی مانند جراحی یا ید رادیواکتیو برای پرکاری تیروئید، میتوانند با از بین بردن بافت تیروئید، باعث کمکاری دائمی شوند.
- تیروئیدیت پس از زایمان: این یک وضعیت موقتی است که ۵ تا ۱۱ درصد زنان را پس از زایمان درگیر میکند.
رویکردهای تشخیصی
تشخیص کمکاری تیروئید با آزمایش خون انجام میشود. الگوی تشخیصی اصلی شامل TSH بالا و FT4 و/یا FT3 پایین است. در مواردی که TSH بالا است اما FT4 طبیعی است، ممکن است فرد دچار کمکاری تحت بالینی (subclinical hypothyroidism) باشد که نیاز به بررسی دقیقتر دارد. برای تأیید بیماری هاشیموتو به عنوان علت، آزمایش آنتیبادیهای تیروئید، به ویژه آنتیبادیهای ضد تیروئید پراکسیداز (Anti-TPO)، تجویز میشود.
مدیریت و درمان
درمان کمکاری تیروئید فرآیندی ساده اما نیازمند دقت و پایبندی است. استاندارد طلایی درمان، مصرف روزانه هورمون مصنوعی تیروئید به نام لووتیروکسین است. این دارو جایگزین هورمونهای از دست رفته بدن میشود و علائم بیماری را برطرف میکند.
یک جنبه مهم در مدیریت این بیماری، آگاهی از تداخلات دارویی و غذایی است. برای اطمینان از جذب حداکثری دارو، لووتیروکسین باید به صورت ناشتا و حداقل ۳۰ تا ۶۰ دقیقه قبل از مصرف هرگونه ماده غذایی مصرف شود. برخی مواد غذایی و مکملها مانند کلسیم، آهن، قهوه و چای میتوانند جذب دارو را به شدت کاهش دهند. مصرف همزمان مکملهای کلسیم و آهن باید حداقل با ۴ ساعت فاصله از مصرف لووتیروکسین انجام شود.
این نکته نشان میدهد که درمان کمکاری تیروئید فراتر از یک نسخه ساده است و بیمار نقش فعالی در مدیریت آن دارد. عدم رعایت این دستورالعملها میتواند اثربخشی دارو را کاهش داده و منجر به ادامه علائم بیماری، حتی با وجود مصرف روزانه دارو، شود. بنابراین، آموزش بیمار در خصوص نحوه صحیح مصرف دارو و پرهیز از تداخلات، بخش جداییناپذیر یک درمان موفق است.
بخش چهارم: ندولهای تیروئید
ماهیت و شیوع
ندولهای تیروئید به تودههای غیرطبیعی در غده تیروئید گفته میشود که میتوانند جامد، پر از مایع (کیستیک) یا مختلط باشند. این ندولها بسیار شایع هستند؛ تخمین زده میشود که نیمی از افراد تا سن ۶۰ سالگی حداقل یک ندول تیروئید دارند. خبر خوش آن است که بیش از ۹۵ درصد این ندولها خوشخیم و غیرسرطانی هستند. با این حال، درصد کمی از آنها (۴ تا ۶.۵ درصد) میتوانند سرطانی باشند که همین امر ارزیابی دقیق آنها را ضروری میسازد.
طبقهبندیهای بالینی
ندولها بر اساس ساختار و عملکرد طبقهبندی میشوند:
- بر اساس ساختار: ندولها میتوانند جامد، کیستیک (پر از مایع) یا مختلط باشند.
- بر اساس عملکرد (اسکن هستهای): ندولها با استفاده از اسکن هستهای به “گرم” و “سرد” تقسیم میشوند.
- ندولهای گرم: این ندولها در اسکن هستهای ید رادیواکتیو را جذب میکنند و اغلب هورمون اضافی تولید میکنند. ندولهای گرم تقریباً همیشه خوشخیم هستند (۹۵٪) و کمتر نگرانکننده تلقی میشوند.
- ندولهای سرد: این ندولها ید رادیواکتیو را جذب نمیکنند و غیرفعال هستند. اگرچه بیشتر ندولهای سرد خوشخیم هستند (۸۵-۹۰٪)، درصد کمی از آنها (۱۰-۱۵٪) میتوانند بدخیم باشند و به همین دلیل نیاز به بررسی دقیقتری دارند.
.
ارزیابی تشخیصی
ارزیابی ندولهای تیروئید یک فرآیند چندمرحلهای است که با سونوگرافی آغاز میشود. سونوگرافی اطلاعات دقیقی درباره اندازه، شکل، حاشیه، و ساختار ندول (جامد یا کیستیک) ارائه میدهد. برای طبقهبندی ریسک بدخیمی، از سیستم TIRADS استفاده میشود که ویژگیهای سونوگرافی ندول را به یک نمره از ۱ تا ۵ تبدیل میکند. نمره TIRADS ۵ نشاندهنده ریسک بسیار بالا و احتمال بدخیمی بیش از ۹۵٪ است، در حالی که TIRADS ۳ احتمال بدخیمی کمتر از ۵٪ را نشان میدهد.
اگر سونوگرافی ویژگیهای مشکوک را نشان دهد یا ندول بزرگ باشد، نمونهبرداری با سوزن ظریف (FNA) انجام میشود که به عنوان استاندارد طلایی برای تشخیص بدخیمی شناخته شده است. FNA به پزشک اجازه میدهد تا سلولهای ندول را برای بررسی زیر میکروسکوپ استخراج کند.
ارتباط با سرطان تیروئید
با وجود شیوع بالا، تنها درصد کمی از ندولها سرطانی هستند. ویژگیهایی که ریسک بدخیمی را افزایش میدهند شامل اندازه ندول (>۴ سانتیمتر)، سفت بودن یا ثابت بودن آن، حاشیه نامنظم و عروق غیرطبیعی است.
ارزیابی خطر سرطانی بودن یک ندول یک طیف خطر است که با ترکیب چندین فاکتور (اندازه، ساختار، عملکرد و ظاهر سونوگرافی) تعیین میشود. برای مثال، یک ندول کیستیک کوچک با TIRADS ۲ ریسک بسیار پایینی دارد، در حالی که یک ندول جامد بزرگ با حاشیه نامنظم و TIRADS ۵، ریسک بسیار بالایی برای سرطانی بودن دارد. سیستم TIRADS به پزشکان کمک میکند تا این فاکتورها را در یک نمره واحد ترکیب کنند و بهترین رویکرد درمانی را انتخاب نمایند. این فرآیند ارزیابی نشان میدهد که علم پزشکی چگونه از یک مشاهده ساده به یک فرآیند پیچیده و دقیق برای مدیریت ریسک تبدیل شده است و به بیماران امکان میدهد تا گزارشهای پزشکی خود را با درک عمیقتری تحلیل کنند.
بخش پنجم: پیشرفتهای نوین و رویکردهای آینده
تشخیصهای مولکولی در ندولها
در مواردی که نتیجه نمونهبرداری با سوزن ظریف (FNA) نامشخص است (به عنوان مثال، در دستهبندی AUS)، تستهای مولکولی به کمک تشخیص میآیند. آزمایشهای ژنتیکی مانند جهشهای BRAF و RAS میتوانند وجود تغییرات ژنی مرتبط با سرطان را شناسایی کنند. به عنوان مثال، جهش در ژن BRAF به ویژه با سرطان پاپیلاری تیروئید مرتبط است. این تستها به پزشکان کمک میکنند تا در خصوص نیاز به جراحی تصمیمگیری کنند و از انجام عملهای غیرضروری برای ندولهای خوشخیم جلوگیری نمایند.
درمانهای کمتهاجمی و شخصیسازیشده
پیشرفتهای جدید در درمان ندولهای خوشخیم شامل روشهای کمتهاجمی مانند فرسایش با فرکانس رادیویی (RFA) و فرسایش با امواج مایکروویو (MWA) است. این روشها با استفاده از گرما، بافت ندول را از بین میبرند و به عنوان جایگزینی برای جراحی در نظر گرفته میشوند.
درمان بیماریهای تیروئید به طور فزایندهای به سمت رویکردهای فردمحور پیش میرود. این بدان معناست که سبک زندگی، عوامل محیطی، و مشخصات ژنتیکی بیمار نقش مهمی در انتخاب درمان دارند. این رویکرد شخصیسازیشده به پزشکان اجازه میدهد تا بهترین برنامه درمانی را بر اساس ویژگیهای منحصربهفرد هر بیمار تنظیم کنند.
نقش دستورالعملهای بالینی
سازمانهای حرفهای مانند انجمن تیروئید آمریکا (ATA) و انجمن غدد درونریز بالینی آمریکا (AACE) نقش حیاتی در تدوین و بهروزرسانی دستورالعملهای بالینی مبتنی بر شواهد دارند. این دستورالعملها، که بر اساس آخرین تحقیقات علمی تدوین میشوند، به پزشکان کمک میکنند تا بهترین رویکردهای تشخیصی و درمانی را برای بیماران به کار گیرند. رعایت این استانداردها تضمین میکند که مراقبتهای پزشکی همواره بر اساس آخرین دانش روز باشد.
نتیجهگیری
غده تیروئید با وجود اندازه کوچک خود، نقشی حیاتی و گسترده در سلامت کل بدن ایفا میکند. از تنظیم متابولیسم تا تأثیر بر رشد، اختلالات عملکردی آن میتواند عواقب جدی داشته باشد. درک عمیق از فیزیولوژی تیروئید و مکانیسمهای کنترل آن، کلید تشخیص و مدیریت صحیح بیماریهای این غده است.
هم پرکاری و هم کمکاری تیروئید با علائم بالینی مشخص و الگوهای هورمونی قابل تشخیص همراه هستند، اما انتخاب روش درمانی مناسب نیازمند در نظر گرفتن علت زمینهای و عواقب بلندمدت آن است. در مورد ندولهای تیروئید، شیوع بالا در کنار احتمال پایین بدخیمی، ارزیابی دقیق و سیستماتیک را ضروری میسازد تا از انجام اقدامات غیرضروری جلوگیری شود. آینده پزشکی تیروئید به سوی رویکردهای شخصیسازیشده، درمانهای کمتهاجمی و استفاده از ابزارهای تشخیصی مولکولی در حال حرکت است که دقت و اثربخشی مراقبتها را به میزان چشمگیری افزایش خواهد داد. در نهایت، پیگیریهای منظم و مشاوره مستمر با پزشک متخصص، کلید مدیریت موفق این بیماریها و تضمین یک زندگی سالم و با کیفیت است.

Add a Comment