سرطان ریه در جهان و ایران: چشمانداز اپیدمیولوژیک، مکانیسمهای مولکولی و پیشرفتهای درمانی
۱. مقدمه: بار جهانی سرطان ریه
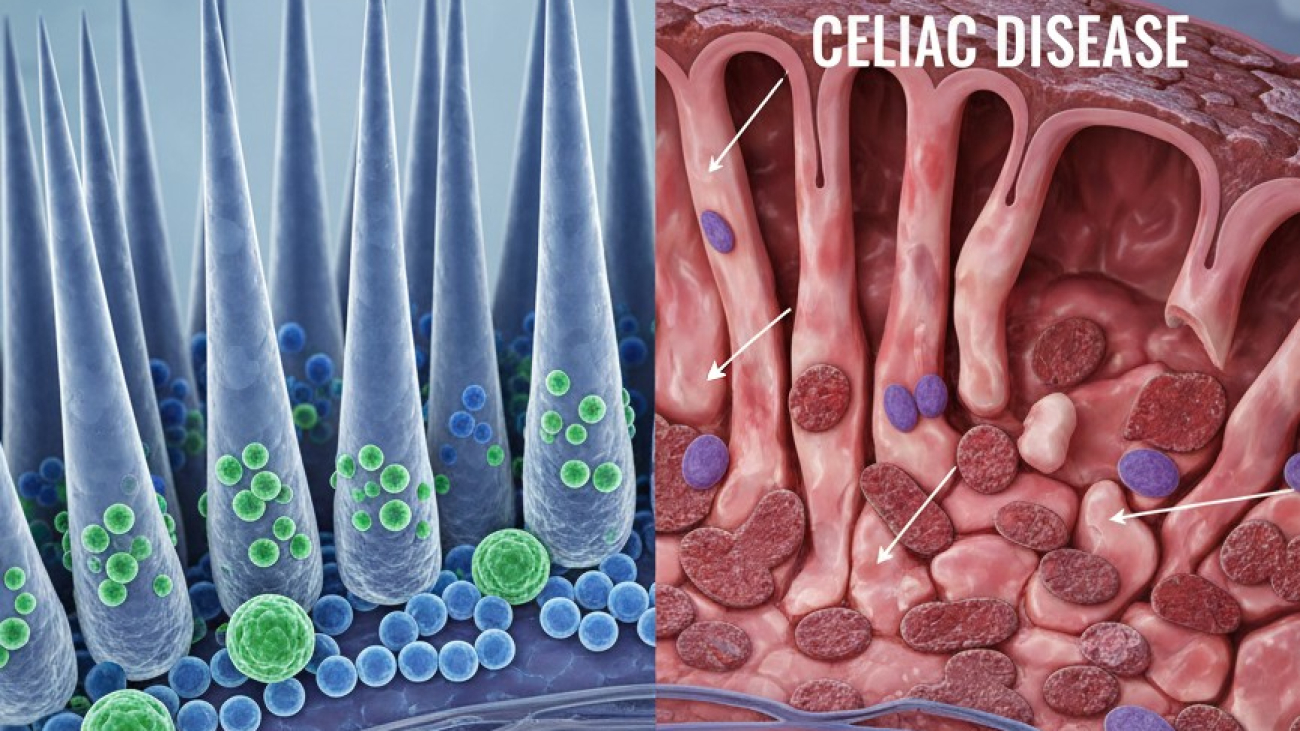
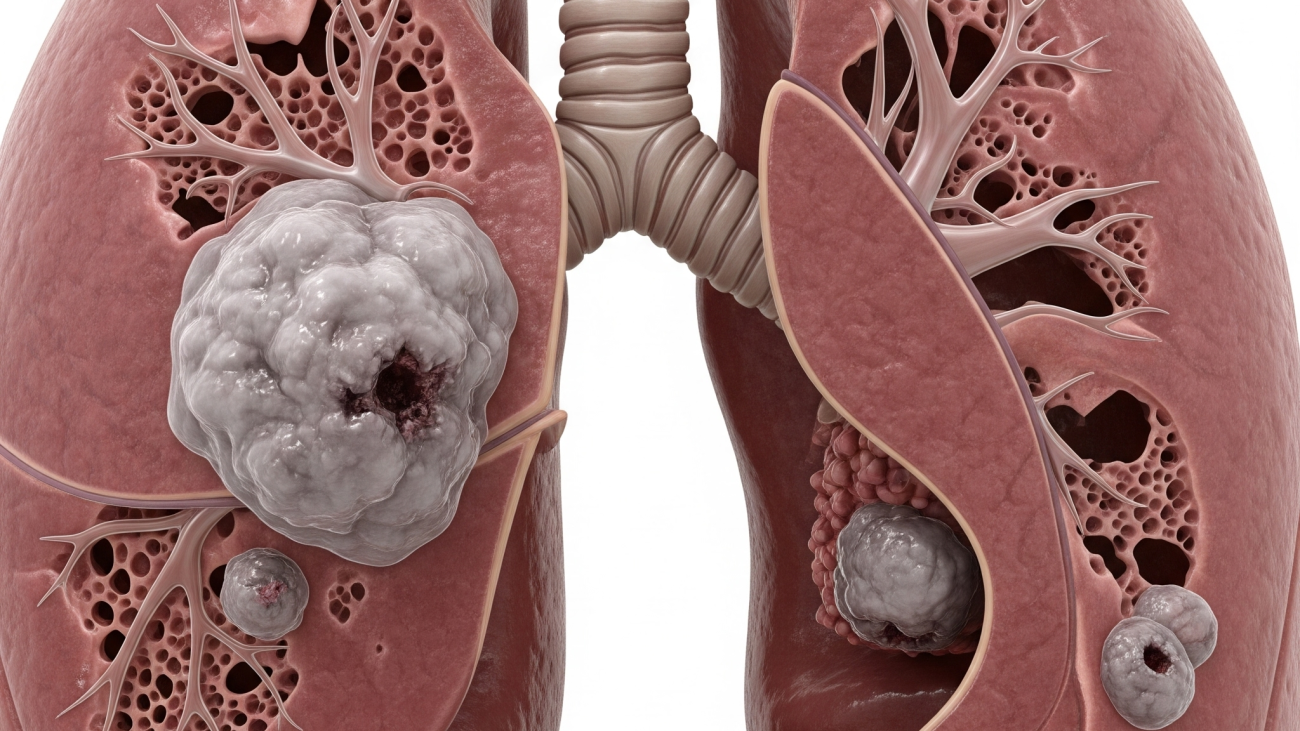
سرطان ریه به عنوان رشد کنترلنشده سلولهای مضر در ریهها تعریف میشود که پتانسیل گسترش به بافتهای اطراف یا سایر اندامها را دارد. این بیماری در سطح جهانی به طور مداوم به عنوان عامل اصلی مرگ و میر ناشی از سرطان و یکی از شایعترین سرطانها شناخته میشود. دادههای سال ۲۰۲۲ نشان میدهد که سرطان ریه با ۲,۴۸۰,۶۷۵ مورد جدید در سراسر جهان، شایعترین سرطان از نظر شیوع بوده است. در همان سال، بیش از ۱.۸ میلیون مرگ (۱,۸۱۷,۴۶۹ مورد) به سرطان ریه نسبت داده شد که آن را به عنوان عامل اصلی مرگ و میر ناشی از سرطان در جهان تثبیت میکند. این آمار بار سنگین جهانی این بیماری را به وضوح نشان میدهد.
با وجود پیشرفتهای چشمگیر در تحقیقات و درمانهای سرطان ریه در دهههای اخیر ، جایگاه ثابت این بیماری به عنوان عامل اصلی مرگ و میر ناشی از سرطان در سطح جهانی نشان میدهد که تلاشهای پیشگیری اولیه و تشخیص زودهنگام هنوز به اندازه کافی تأثیرگذار نبودهاند. این وضعیت یک شکاف عمده در سلامت عمومی را نشان میدهد، به ویژه در مناطقی که شیوع و مرگ و میر بالایی دارند. نرخ بالای مرگ و میر به این معنی است که بخش بزرگی از موارد در مراحل پیشرفته تشخیص داده میشوند، جایی که نتایج درمان به طور کلی ضعیف است. این امر بر نیاز مبرم به راهبردهای تشخیص زودهنگام مؤثرتر و دسترسی گستردهتر به درمانهای پیشرفته در سراسر جهان تأکید میکند.
۲. اپیدمیولوژی جهانی سرطان ریه: آمار و روندها
شیوع، مرگ و میر و فراوانی در سراسر جهان (GLOBOCAN 2022)
در سال ۲۰۲۲، سرطان ریه با ۲,۴۸۰,۶۷۵ مورد جدید، شایعترین سرطان از نظر شیوع در جهان بود. نرخ استاندارد شده سنی (ASR) برای شیوع جهانی ۲۳.۶ در هر ۱۰۰,۰۰۰ نفر بود. از نظر مرگ و میر، سرطان ریه با ۱,۸۱۷,۴۶۹ مورد مرگ، عامل اصلی مرگ و میر ناشی از سرطان در جهان بود و نرخ استاندارد شده سنی مرگ و میر ۱۶.۸ در هر ۱۰۰,۰۰۰ نفر گزارش شد. تعداد موارد شیوع ۵ ساله در جهان به ۳,۲۲۲,۰۶۰ مورد رسید. برای هر دو جنس، سرطان ریه رتبه اول را در شیوع و مرگ و میر به خود اختصاص داده است. در مردان، این بیماری شایعترین سرطان از نظر موارد جدید و مرگ و میر است، در حالی که در زنان، پس از سرطان سینه در رتبه دوم شیوع و مرگ و میر قرار دارد.
توزیع جغرافیایی و انواع سرطانهای پیشرو
قاره آسیا بیشترین بار سرطان ریه را به دوش میکشد و ۶۳.۱ درصد از موارد جدید (۱,۵۶۶,۳۵۵ مورد) و ۶۲.۹ درصد از مرگ و میرها (۱,۱۴۲,۳۹۷ مورد) را به خود اختصاص داده است. اروپا با ۱۹.۵ درصد از موارد و ۲۰.۷ درصد از مرگ و میرها در رتبه بعدی قرار دارد و آمریکای شمالی با ۱۰.۴ درصد از موارد و ۸.۳ درصد از مرگ و میرها در جایگاه سوم است. سایر قارهها (آمریکای لاتین و کارائیب، آفریقا، اقیانوسیه) سهم کمتری دارند، اما همچنان با چالشهای قابل توجهی روبرو هستند.
سهم بالای آسیا از شیوع و مرگ و میر جهانی سرطان ریه (بیش از ۶۰ درصد) تنها با اندازه جمعیت قابل توجیه نیست. این وضعیت نشاندهنده ترکیبی از عوامل مانند شیوع بالای سیگار کشیدن (هم تاریخی و هم کنونی)، آلودگی هوای قابل توجه، مواجهههای شغلی، و احتمالاً زیرساختهای مراقبتهای بهداشتی و قابلیتهای تشخیصی متفاوت است. این تمرکز منطقهای، نیاز به کمپینهای بهداشت عمومی هدفمند و تخصیص منابع را ضروری میسازد. درک عوامل خاص پشت این بار سنگین در آسیا برای راهبردهای کنترل جهانی سرطان حیاتی است و نشان میدهد که رویکرد “یک اندازه برای همه” برای پیشگیری و درمان سرطان ریه کافی نیست و باید به عوامل خاص منطقهای توجه شود.
نرخ بقای ۵ ساله جهانی
نرخ بقای نسبی/خالص ۵ ساله برای سرطان ریه به طور کلی پایین است و در بیشتر مناطق بین ۱۰ تا ۲۰ درصد متغیر است. نرخ بقا بسته به مرحله تشخیص به طور قابل توجهی متفاوت است: برای سرطانهای موضعی، این نرخ بین ۶۰.۶٪ تا ۶۷٪ (برای سرطان ریه غیرکوچک سلول NSCLC) است. برای سرطانهای منطقهای، این نرخ ۳۴.۶٪ تا ۴۰٪ (برای NSCLC) است. اما برای سرطانهای متاستاتیک یا دوردست، این نرخ به شدت کاهش مییابد و بین ۹.۴٪ تا ۱۲٪ (برای NSCLC) است. به طور کلی، نرخ بقای ۵ ساله برای تمامی مراحل سرطان ریه در حدود ۲۸.۶٪ در سطح جهانی و تقریباً ۲۰٪ در انگلستان است. سرطان ریه سلول کوچک (SCLC) نرخ بقای ۵ ساله کلی پایینتری (۹٪) نسبت به سرطان ریه غیرکوچک سلول (NSCLC) (۳۲٪) دارد.
تفاوت فاحش در نرخ بقای ۵ ساله بین سرطان ریه موضعی (۶۰-۶۷٪) و سرطان متاستاتیک (۹-۱۲٪) به وضوح نشان میدهد که تشخیص زودهنگام برای بهبود نتایج بیماران حیاتی است. این واقعیت که “بیشتر سرطانهای ریه پس از گسترش به سایر نقاط بدن تشخیص داده میشوند، زمانی که بقا کمترین میزان را دارد” ، مستقیماً نرخ بقای کلی پایین را توضیح میدهد. این موضوع بر نیاز مبرم به برنامههای غربالگری مؤثر برای افراد در معرض خطر بالا و افزایش آگاهی عمومی از علائم اولیه تأکید دارد تا تشخیص به سمت مراحل اولیه و قابل درمانتر سوق یابد.
۳. وضعیت سرطان ریه در ایران: چالشها و چشماندازها
نرخ شیوع، مرگ و میر و فراوانی در ایران (GLOBOCAN 2022)
در سال ۲۰۲۲، ایران ۱۰,۹۳۴ مورد جدید سرطان ریه را گزارش کرد که در رتبه چهارم در میان تمام سرطانها قرار گرفت. سرطان ریه دومین عامل اصلی مرگ و میر ناشی از سرطان در ایران بود و ۹,۸۹۵ مورد مرگ در سال ۲۰۲۲ به آن نسبت داده شد. نرخ استاندارد شده سنی شیوع (ASIR) ۱۳.۹ در هر ۱۰۰,۰۰۰ نفر و نرخ استاندارد شده سنی مرگ و میر (ASMR) ۱۱.۰ در هر ۱۰۰,۰۰۰ نفر بود. برای مردان، سرطان ریه سومین سرطان شایع (۷,۵۷۶ مورد) و دومین عامل اصلی مرگ و میر بود. برای زنان، این بیماری چهارمین سرطان شایع (۳,۳۵۸ مورد) و سومین عامل اصلی مرگ و میر بود. موارد شیوع ۵ ساله در ایران ۱۵,۳۷۵ مورد گزارش شد. خطر ابتلا به سرطان ریه قبل از ۷۵ سالگی ۱.۴٪ و خطر مرگ ناشی از آن ۱.۲٪ است.
مقایسه وضعیت اپیدمیولوژیک ایران با روندهای جهانی
نرخ استاندارد شده سنی (ASR) ایران (۱۳.۹ در سال ۲۰۲۲ یا ۲۱ در مطالعات دیگر ) کمتر از کشورهایی مانند انگلستان (ASR 46) و ایالات متحده (ASR 38.4) است. با این حال، شیوع سرطان ریه در ایران به طور پیوسته در مردان و زنان در حال افزایش است. این روند مشابه روندهای مشاهده شده در جنوب و شرق اروپا است و با کاهش نرخها در ایالات متحده و بسیاری از کشورهای اروپای غربی تضاد دارد.
در حالی که نرخ استاندارد شده سنی شیوع سرطان ریه در ایران در حال حاضر پایینتر از بسیاری از کشورهای غربی است، روند صعودی مداوم در شیوع و پیشبینی دو برابر شدن موارد سرطان در دو دهه آینده نشان میدهد که ایران در فاز اولیه اپیدمی سرطان ریه خود قرار دارد. این وضعیت الگوهای تاریخی مشاهده شده در کشورهای توسعهیافته را قبل از رسیدن به اوج و شروع کاهش نرخها منعکس میکند. این یک فرصت حیاتی برای مداخله است. اقدامات پیشگیرانه بهداشت عمومی و توسعه زیرساختها در حال حاضر میتواند شدت اپیدمی قریبالوقوع را کاهش دهد و از تجربیات کشورهایی که قبلاً از اوج خود عبور کردهاند، درس بگیرد.
روندهای تاریخی و پیشبینیها برای سرطان ریه در ایران
نرخ استاندارد شده سنی شیوع (ASIR) سرطان ریه در ایران از ۱.۳ در سال ۱۹۹۰ به ۸.۹ در سال ۲۰۱۶ افزایش یافته است که نشاندهنده یک روند صعودی است. سرطان سومین عامل اصلی مرگ و میر در ایران پس از بیماریهای قلبی عروقی و حوادث است. با افزایش امید به زندگی و جمعیت سالخورده در ایران، پیشرفتهای تکنولوژژیک و دور شدن از محیطی پاک و سالم بدون مواد سرطانزای صنعتی، انتظار میرود شیوع سرطان در دو دهه آینده دو برابر شود. سازمان بهداشت جهانی (WHO) پیشبینی میکند که موارد سرطان در ایران تا سال ۲۰۲۵ به ۸۶,۹۴۷ مورد و مرگ و میر ناشی از سرطان به ۶۲,۸۹۷ مورد برسد.
اینکه سرطان ریه در ایران از نظر شیوع در رتبه چهارم قرار دارد اما از نظر مرگ و میر در رتبه دوم است ، نشان میدهد که تعداد نامتناسبی از موارد تشخیص داده شده کشنده هستند. این موضوع، همراه با بار اقتصادی بالای ناشی از مرگ و میر (۸۱.۹٪) ، به شدت دلالت بر این دارد که بخش قابل توجهی از موارد سرطان ریه در ایران در مراحل پیشرفته و غیرقابل درمان تشخیص داده میشوند. این وضعیت نیاز مبرم به بهبود مکانیسمهای تشخیص زودهنگام، افزایش قابلیتهای تشخیصی و احتمالاً دسترسی بهتر به گزینههای درمانی مؤثر برای بهبود نرخ بقا و کاهش بار کلی بیماری در ایران را برجسته میکند.
نرخ استاندارد شده سنی (ASR) پایینتر در ایران در مقایسه با برخی کشورهای غربی به صراحت با “دسترسی مشکلساز به ضایعات ریه و کمبود امکانات و تجهیزات تشخیصی و نمونهبرداری در برخی نقاط ایران” مرتبط است. این امر نشان میدهد که شیوع گزارش شده ممکن است تخمین کمتری از بار واقعی بیماری باشد، که به دلیل محدودیتهای تشخیصی پنهان مانده است. این موضوع به یک چالش قابل توجه در ارزیابی دقیق چشمانداز اپیدمیولوژیک و برنامهریزی مؤثر مداخلات مراقبتهای بهداشتی اشاره دارد. بهبود زیرساختهای تشخیصی و دسترسی به آنها نه تنها برای نتایج بیمار بلکه برای به دست آوردن دادههای اپیدمیولوژیک قابل اعتماد نیز حیاتی است.
بار اقتصادی سرطان ریه در ایران
بار اقتصادی سرطان ریه در ایران قابل توجه بود و در سال ۲۰۱۴ حدود ۳,۲۲۵,۹۹۸,۵۵۵,۰۹۰ ریال تخمین زده شد. اجزای اصلی این هزینه با مرگ و میر (۸۱.۹٪) و بستری شدن در بیمارستان (۷.۶٪) مرتبط بود. مرگ و میر ناشی از سرطان ریه که به سیگار کشیدن نسبت داده میشود، بار مالی قابل توجهی را بر بیمارستانها در ایران تحمیل کرده است.
عوامل خطر اولیه
نقش محوری مصرف دخانیات:
سیگار کشیدن به وضوح عامل خطر اصلی سرطان ریه است و تقریباً ۸۰٪ از مرگ و میرهای ناشی از سرطان ریه را تشکیل میدهد. خطر با مدت و شدت سیگار کشیدن افزایش مییابد. سیگار برگ، پیپ و حتی سیگارهای “کمقطران” یا “سبک” خطرات مشابهی دارند. دود دست دوم (دود محیطی تنباکو) سومین عامل شایع سرطان ریه در ایالات متحده است و خطر را برای افراد غیرسیگاری به طور قابل توجهی افزایش میدهد. در ایران، سیگار کشیدن عامل خطر اصلی است ، و ۶۵.۸۴٪ از بیماران سرطان ریه ایرانی سیگاری بودهاند. شیوع سیگار کشیدن در سال ۲۰۱۶ ۹.۶٪ و دود دست دوم ۳۱.۵٪ در میان بزرگسالان بود. قلیان کشیدن (پیپ آبی) ایمنتر از سیگار کشیدن نیست؛ این عمل کاربران را در معرض سطوح بالایی از مواد شیمیایی مضر (قطران، مونوکسید کربن، فلزات سنگین، مواد سرطانزا) و نیکوتین قرار میدهد. یک مطالعه مورد-شاهدی در ایران ارتباط معنیداری بین قلیان کشیدن و سرطان ریه یافت.
عوامل محیطی و شغلی:
رادون: دومین عامل اصلی سرطان ریه در ایالات متحده و عامل اصلی در میان افراد غیرسیگاری است. این گاز رادیواکتیو طبیعی میتواند در محیطهای بسته متمرکز شود.
آزبست: مواجهه با آزبست به طور قابل توجهی خطر سرطان ریه را افزایش میدهد، به ویژه در سیگاریها. مقررات دولتی استفاده از آن را کاهش داده است، اما همچنان در ساختمانهای قدیمیتر یک خطر محسوب میشود.
سایر مواد سرطانزا در محیط کار: مواجهه با سنگهای رادیواکتیو (اورانیوم)، مواد شیمیایی استنشاقی (آرسنیک، بریلیوم، کادمیوم، سیلیس، وینیل کلراید، ترکیبات نیکل/کروم، محصولات زغال سنگ، گاز خردل، اترهای کلرومتیل) و دود دیزل. مواجهههای شغلی با گرد و غبار معدنی، ترکیبات شیمیایی و فلزات سنگین در یک مطالعه ایرانی به عنوان عوامل خطر مستقل برای سرطان ریه شناسایی شدند.
آلودگی هوا: ذرات معلق (PM2.5، PM10) و دیاکسید گوگرد (SO2) عوامل خطر مهمی هستند. تقریباً ۶۶۸ مرگ ناشی از سرطان ریه در ایران در سال ۲۰۱۶ به مواجهه طولانیمدت با ذرات معلق نسبت داده شد.
سایر عوامل:
زمینههای ژنتیکی: به عنوان یک عامل خطر شناخته شده است.
عفونت ویروس پاپیلومای انسانی (HPV): در ایران به عنوان یک عامل خطر مهم گزارش شده است.
مکملهای غذایی: مکملهای بتاکاروتن با افزایش خطر سرطان ریه در سیگاریها مرتبط بودهاند، که نشاندهنده لزوم پرهیز از آنهاست.
بیماریهای مزمن ریوی و سل: میتوانند در ایجاد کارسینومای اولیه ریه مؤثر باشند.
رژیم غذایی گیاهخواری: در ایران به عنوان یک عامل محافظتی در نظر گرفته شده است.
مکانیسمهای مولکولی ناشی از دود سیگار
آسیب DNA و جهشها (با تمرکز بر جهشهای p53):
دود سیگار حاوی هزاران ترکیب است که حداقل ۶۰ مورد آن به عنوان مواد سرطانزا طبقهبندی شدهاند (مانند هیدروکربنهای آروماتیک چندحلقهای (PAH) نظیر بنزو[a]پیرن (BaP) و نیتروزآمینهای N- مانند NNK). مواجهه مزمن با این ترکیبات منجر به تشکیل ادکتهای DNA میشود که به نوبه خود جهشهای سرطانزا را ایجاد میکنند. نرخ بالای جهش در سراسر ژنوم در افراد سیگاری مشاهده میشود که اغلب با تغییرات خاص G به T مشخص میشود و به عنوان “امضای سیگار کشیدن” شناخته میشود. این جهشها به طور مکرر در ژنهای حیاتی مانند KRAS و ژن سرکوبکننده تومور TP53 یافت میشوند. پروتئین p53 شایعترین سرکوبکننده تومور جهشیافته در سرطان است و جهشهای آن عملکردهای حیاتی سلولی را به خطر میاندازند. جهشها در TP53 میتوانند منجر به از دست دادن عملکرد سرکوبکننده تومور و حتی ایجاد فنوتیپهای “کسب عملکرد” شوند که تومورزایی را تقویت میکنند.
استرس اکسیداتیو و التهاب مزمن:
دود سیگار حاوی گونههای فعال اکسیژن (ROS) و گونههای فعال نیتروژن (RNS) است که استرس اکسیداتیو را القا میکنند. استرس اکسیداتیو به ماکرومولکولهایی مانند لیپیدها (پراکسیداسیون لیپید، تشکیل ادکتهای جهشزا مانند M1dG)، پروتئینها (کربونیلاسیون، نیتراسیون) و DNA (تشکیل ۸-اگزودئوکسیگوانوزین (۸-oxodG) که منجر به تغییرات G:C→T:A میشود) آسیب میرساند. آسیب اکسیداتیو پاسخ التهابی را تحریک میکند، جایی که سلولهای ایمنی ROS بیشتری آزاد میکنند و یک “چرخه معیوب” ایجاد میشود که استرس اکسیداتیو را تشدید کرده و سرطانزایی را ترویج میکند. تخمین زده میشود که التهاب مزمن به ۱۵ تا ۲۵ درصد از سرطانهای انسانی کمک میکند.
تغییرات اپیژنتیک:
اپیژنتیک به تغییرات ارثی و برگشتپذیر در بیان ژن اشاره دارد که توالی DNA زیرین را تغییر نمیدهد. اجزای دود سیگار میتوانند متیلاسیون DNA غیرطبیعی (مانند هایپرمتیلاسیون خاص مکان و هایپومتیلاسیون کلی ژنوم) و تغییرات هیستون را القا کنند. فلزات سنگین موجود در دود میتوانند متیلترانسفرازهای DNA (DNMTs) را مهار کنند. این تغییرات اپیژنتیک میتوانند سلولهای اپیتلیال برونش انسانی را برای تبدیل شدن توسط یک انکوژن منفرد “حساس” کنند، حتی در غیاب جهشهای ژنی محرک اولیه. این نشان میدهد که تغییرات اپیژنتیک میتوانند سلولها را برای ضربههای ژنتیکی بعدی آماده کنند و نقش مهمی در شروع تومورزایی ایفا کنند.
مکانیسمهای مولکولی ناشی از سیگار کشیدن، پیچیده و چندوجهی هستند. دود سیگار نه تنها باعث آسیب مستقیم به DNA میشود، بلکه استرس اکسیداتیو، التهاب مزمن و تغییرات اپیژنتیک را نیز القا میکند. این مکانیسمها به هم مرتبط هستند و یک “چرخه معیوب” را تشکیل میدهند که در آن یکی دیگری را تشدید میکند. علاوه بر این، تغییرات اپیژنتیک میتوانند سلولها را برای جهشهای ژنتیکی بعدی “حساس” کنند. این درک عمیقتر از صرفاً فهرست کردن عوامل خطر، تعامل پیچیده بیولوژیکی را توضیح میدهد. این درک جامع از مکانیسمهای مولکولی دشواری معکوس کردن آسیب را پس از شروع سیگار کشیدن برجسته میکند و بر مزایای عمیق ترک سیگار و پیشگیری اولیه تأکید دارد. همچنین اهداف بالقوه برای راهبردهای شیمیدرمانی پیشگیرانه با هدف کاهش استرس اکسیداتیو یا تغییرات اپیژنتیک را نشان میدهد.
در حالی که سیگار کشیدن یک عامل خطر اولیه جهانی است، اشاره صریح به قلیان کشیدن و آلایندههای خاص هوا (PM2.5، PM10، SO2) به عنوان عوامل مهم در ایران، درک محلی از اتیولوژی بیماری را فراهم میکند. یافتهای که رژیم غذایی گیاهخواری یک عامل محافظتی است نیز یک نکته منحصر به فرد منطقهای است. کمپینهای بهداشت عمومی و مداخلات سیاستی در ایران باید برای رسیدگی به این عوامل خطر محلی خاص، از جمله راهبردهای جامع کنترل دخانیات که شامل مصرف قلیان میشود و ابتکاراتی برای بهبود کیفیت هوا، تنظیم شوند.
روشهای تشخیصی پیشرفته
تصویربرداری:
توموگرافی کامپیوتری با دوز پایین (LDCT) غربالگری را متحول کرده است و به طور قابل توجهی مواجهه با اشعه را کاهش میدهد در حالی که حساسیت بالایی برای تشخیص مراحل اولیه دارد. سیتی اسکن با وضوح بالا (HRCT) تصاویر واضحتری را برای تجزیه و تحلیل دقیق بافت ریه و شناسایی ندولها فراهم میکند. سیتی اسکن چند آشکارساز (MDCT) امکان تصویربرداری سریع و گسترده را فراهم میکند که برای برنامهریزی جراحی و رادیوتراپی حیاتی است. فناوریهای PET-CT نیز امکان شناسایی زودهنگام تومور را فراهم میکنند.
بیوپسی و بیوپسی مایع:
روشهای سنتی شامل بیوپسی با سوزن، برونکوسکوپی، توراکوسکوپی، جراحی توراکوسکوپی با کمک ویدئو (VATS) و توراسنتز برای جمعآوری بافت/مایع هستند. بیوپسی مایع، که نمونههای خون را برای یافتن سلولهای تومور یا نشانگرهای مولکولی تجزیه و تحلیل میکند، یک نوآوری قابل توجه برای تشخیص و نظارت است.
هوش مصنوعی (AI) و توالییابی نسل بعدی (NGS):
الگوریتمهای هوش مصنوعی برای تجزیه و تحلیل تصاویر پزشکی استفاده میشوند که دقت تشخیصی را افزایش داده و خطای انسانی را کاهش میدهند. NGS یک ابزار قدرتمند برای تشخیص زودهنگام سرطان و شناسایی تغییرات مولکولی خاص در نمونههای بیولوژیکی مختلف (خون، پلاسما، بافت، ادرار) به دلیل سرعت، کارایی و هزینه کم آن است.
غربالگری
اثربخشی: دو کارآزمایی تصادفیسازی شده (NLST، NELSON) نشان دادند که غربالگری با LDCT مرگ و میر ناشی از سرطان ریه را در افراد پرخطر (۵۵-۷۴ سال، سابقه سیگار کشیدن ۳۰ پاکت-سال یا بیشتر، سیگاری فعلی یا ترک کرده در ۱۵ سال گذشته) ۲۰-۲۴٪ کاهش میدهد.
چالشها و محدودیتها:
آزمایشهای مثبت کاذب: نرخهای بالا (۲۳.۳٪ در NLST، ۱۰.۴٪ در NELSON) میتواند منجر به اقدامات تهاجمی غیرضروری شود. عوارض ناشی از این اقدامات میتواند رخ دهد (۰.۰۶٪ در NLST)، که به ویژه برای سیگاریهای سنگین با بیماریهای همراه مشکلساز است.
تشخیص بیش از حد (Overdiagnosis): برخی از سرطانهای شناسایی شده توسط غربالگری ممکن است از نظر بالینی معنیدار نشده باشند، که منجر به درمان غیرضروری میشود. تخمینها به طور گستردهای متفاوت است (به عنوان مثال، ۳٪ در پیگیری طولانیمدت NLST، ۶۷٪ در کارآزمایی دانمارکی).
مواجهه با اشعه: غربالگری با LDCT شامل مواجهه با اشعه است، اگرچه دوز متوسط آن پایین است. در حالی که مزایای آن به طور کلی از خطرات بیشتر است، افراد جوانتر ممکن است مستعدتر به سرطان ناشی از اشعه باشند.
تأثیر بر ترک سیگار: یافتهها در مورد اینکه آیا غربالگری ترک سیگار را تشویق میکند، متفاوت است.
غربالگری با LDCT به طور قابل توجهی مرگ و میر ناشی از سرطان ریه را کاهش میدهد که یک مزیت آشکار است. با این حال، معایب قابل توجهی مانند نرخ بالای مثبت کاذب، خطر تشخیص بیش از حد و مواجهه با اشعه را به همراه دارد. این بدان معنی است که در حالی که غربالگری مؤثر است، اجرای آن نیازمند انتخاب دقیق بیمار، پروتکلهای پیگیری قوی و درک روشنی از آسیبهای احتمالی برای اطمینان از سود خالص است. این موضوع پیچیدگی مداخلات بهداشت عمومی در انکولوژی را برجسته میکند. تصمیم برای اجرای برنامههای غربالگری گسترده باید مزایای تشخیص زودهنگام را با خطرات اقدامات غیرضروری، اضطراب بیمار و فشار بر منابع متعادل کند.
آزمایشهای مولکولی و نقش آنها در درمان هدفمند و ایمونوتراپی
مبانی پزشکی دقیق: پیشرفتها در ژنتیک و بیوتکنولوژی، درمانهای هدفمند را بر اساس ویژگیهای مولکولی تومور ممکن ساخته است.
نشانگرهای زیستی کلیدی و مکانیسمها:
EGFR (گیرنده فاکتور رشد اپیدرمال): بیان بیش از حد یا جهش در ژن EGFR باعث رشد سریع سلولهای سرطانی میشود. مهارکنندههای EGFR این سیگنالهای رشد را مسدود میکنند. نمونهها شامل اوزیمرتینیب، افاتینیب، ارلوتینیب، گفیتینیب هستند.
ALK (کیناز لنفوم آناپلاستیک): بازآرایی در ژن ALK یک پروتئین ALK غیرطبیعی تولید میکند که رشد سرطان را تقویت میکند. مهارکنندههای ALK به طور خاص این پروتئین را هدف قرار میدهند. نمونهها شامل الکتینیب، بریگاتینیب، لورلاتینیب هستند.
ROS1: بازآرایی در ژن ROS1 مشابه ALK است و توسط مهارکنندههای ROS1 هدف قرار میگیرد.
BRAF, RET, MET, HER2, NTRK: جهشهای دیگری که میتوانند توسط داروهای خاصی هدف قرار گیرند.
PD-L1 (لیگاند مرگ برنامهریزی شده ۱): PD-L1 بر روی سلولهای تومور بیان میشود و به PD-1 بر روی سلولهای T متصل میشود و پاسخ ایمنی را مهار میکند. ایمونوتراپی (مهارکنندههای ایست بازرسی ایمنی، ICIs) این تعامل را مسدود کرده و سلولهای T را برای مبارزه با سرطان فعال میکند. بیان بالاتر PD-L1 اغلب پاسخ بهتر به ICIs را پیشبینی میکند.
تعاملات پیچیده: فعالسازی EGFR میتواند بیان PD-L1 را افزایش دهد و به فرار ایمنی کمک کند. با این حال، NSCLC با جهش EGFR اغلب کارایی کمتری با ICIs به دلیل ریزمحیط تومور کمتر ایمنیزا و بار جهش تومور پایینتر نشان میدهد
چالشها در دسترسی به تشخیصهای پیشرفته در ایران
“دسترسی مشکلساز به ضایعات ریه و کمبود امکانات و تجهیزات تشخیصی و نمونهبرداری در برخی نقاط ایران” به نرخ استاندارد شده سنی شیوع (ASR) پایینتر گزارش شده کمک میکند. نرخ آزمایشهای مولکولی در اکثر کشورها کمتر از ۵۰٪ است، با هزینهها، کیفیت/استانداردها، زمان پاسخ، دسترسی و آگاهی به عنوان موانع اصلی. اگرچه به صراحت برای ایران بیان نشده است، اما بسیار محتمل است که این موانع در ایران نیز وجود داشته باشند، به ویژه با توجه به وضعیت ایران به عنوان یک کشور در حال توسعه. با وجود پیشرفتها در تصویربرداری (LDCT, HRCT, MDCT) و اشاره به آزمایش جهش ژنتیکی در ایران ، جزئیات خاصی در مورد چالشهای دسترسی به این تشخیصهای پیشرفته ارائه نشده است.
این وضعیت یک شکاف قابل توجه ایجاد میکند که در آن درمانهای پیشرفته و طولانیکننده عمر در سطح جهانی در دسترس هستند، اما کاربرد آنها در مناطقی مانند ایران به دلیل فقدان قابلیتهای تشخیصی اساسی محدود است. پر کردن این شکاف برای بهبود نتایج بیماران و دستیابی به برابری سلامت حیاتی است.
۶. گزینههای درمانی و پیشرفتهای اخیر در مدیریت سرطان ریه
درمانهای متعارف و نوین
درمانهای متعارف:
جراحی: یک درمان اولیه برای سرطانهای ریه در مراحل اولیه است. انواع آن شامل برداشتن سگمنتال/وج (برداشتن بخش کوچکی)، لوبکتومی (برداشتن کامل یک لوب)، پنومونکتومی (برداشتن کامل یک ریه) و رزکسیون اسلیو (برداشتن بخشی از برونش) است. تکنیکهای کمتهاجمی مانند جراحی توراکوسکوپی با کمک ویدئو (VATS) به دلیل درد کمتر، بستری کوتاهتر در بیمارستان و بهبودی سریعتر برای NSCLC در مراحل اولیه ترجیح داده میشوند.
رادیوتراپی: از پرتوهای پرانرژی برای از بین بردن سلولهای سرطانی، به تنهایی یا همراه با شیمیدرمانی استفاده میکند. تکنیکها شامل پرتو درمانی خارجی، پروتون درمانی، سایبرنایف و توموتراپی هستند. همچنین میتوان از آن برای مراقبتهای تسکینی استفاده کرد.
شیمیدرمانی: اغلب ترکیبی از چندین دارو است که به صورت وریدی برای توقف رشد سلولهای سرطانی تجویز میشود. میتوان آن را قبل (نئوادجوانت) یا بعد (ادجوانت) از جراحی یا در ترکیب با سایر درمانها استفاده کرد.
درمانهای پیشرفته:
درمان دارویی هدفمند: داروهایی که برای هدف قرار دادن تغییرات مولکولی خاص (جهشها) در سلولهای سرطانی که به رشد آنها کمک میکنند، طراحی شدهاند. نمونهها شامل مهارکنندههای جهشهای EGFR, ALK, ROS1, BRAF, RET, MET و HER2 هستند. مهارکنندههای رگزایی از تشکیل رگهای خونی جدید جلوگیری میکنند.
ایمونوتراپی: سیستم ایمنی بدن را برای مبارزه با سرطان با آشکار کردن سلولهای سرطانی که از سیستم ایمنی پنهان میشوند، فعال میکند. مهارکنندههای PD-1/PD-L1 نمونههای کلیدی هستند که کاهش قابل توجهی در پیشرفت بیماری و بهبود بقا را نشان میدهند. برای تمام مراحل NSCLC، از جمله تنظیمات نئوادجوانت/ادجوانت استفاده میشود.
الکتروشیمیدرمانی (ECT): یک رویکرد درمانی هدفمند نوین است که از پالسهای الکتریکی برای افزایش نفوذپذیری غشای سلولهای سرطانی استفاده میکند و اثربخشی داروهای ضد سرطان را افزایش میدهد. اگرچه کاربرد آن در سرطان ریه به طور خاص در سطح جهانی جزئیات داده نشده است، ایران تولید داخلی دستگاههای ECT را توسعه داده است.
درمان با سلولهای T CAR: نوعی ژندرمانی است که در آن سلولهای ایمنی بیمار برای مبارزه با سرطان اصلاح میشوند. در حال حاضر در ایران در مرحله کارآزمایی بالینی برای سرطانهای کودکان است.
یوندرمانی: یک درمان پیشرفته است که در ژوئیه ۲۰۲۱ در ایران افتتاح شد و هدف آن ارائه درمان قطعی برای انواع سرطان است.
وضعیت دسترسی به درمانهای پیشرفته در ایران
زیرساخت و سرمایهگذاری: ایران مراکز درمانی پیشرفته سرطان را در تهران (مارس ۲۰۲۳) افتتاح کرده است که مجهز به دستگاههای مدرن مانند شتابدهندههای خطی، سایبرنایف، توموتراپی و شبیهسازهای CT هستند که برخی از آنها برای اولین بار در غرب آسیا استفاده میشوند. یک مرکز یوندرمانی نیز در سال ۲۰۲۱ افتتاح شد.
نوآوری داخلی: ایران اولین کشور آسیایی است که تولید داخلی دستگاههای ابلیشن الکتروشیمیدرمانی (ECT) را توسعه داده است و به ایتالیا و انگلستان در این زمینه پیوسته است. این تولید داخلی با هدف بهبود دسترسی از طریق کاهش وابستگی به فناوری خارجی و احتمالاً کاهش هزینهها و زمان انتظار است.
چالشها در دسترسی:
هزینههای گزاف: دسترسی به داروهای جدید و هدفمند و ایمونوتراپی اغلب به دلیل توانایی سیستمهای بهداشتی ملی و شرکتهای بیمه برای پرداخت محدود است. دوروالوماب، یک ایمونوتراپی کلیدی، حتی در کشورهای توسعهیافته “گران” تشخیص داده شد، چه رسد به کشورهای با درآمد پایین و متوسط.
کمبود زیرساخت و پرسنل برای کارآزماییهای بالینی: یک مانع اصلی برای پیشبرد مراقبت از سرطان در محیطهای با منابع محدود مانند ایران، کمبود کلی زیرساخت و پرسنل آموزشدیده برای انجام کارآزماییهای بالینی است که منجر به عدم دسترسی به درمانهای نوآورانه جدیدتر میشود.
موانع خارجی: تحریمها، هزینههای بالا و موانع لجستیکی میتوانند دسترسی به داروهای نجاتبخش را که در ایران در دسترس نیستند، “تقریباً غیرممکن” کنند.
دسترسی نابرابر: با وجود پیشرفتها، “دسترسی نابرابر به درمان” یک چالش مهم باقی مانده است.
ایران سرمایهگذاریهای قابل توجهی در مراکز درمانی پیشرفته سرطان انجام داده و حتی در حال توسعه درمانهای داخلی با فناوری بالا مانند الکتروشیمیدرمانی است. این امر نشاندهنده تعهد به مراقبتهای مدرن سرطان است. با این حال، همزمان، کشور با “دسترسی نابرابر به درمان” ، داروهای پیشرفته گرانقیمت و موانع ناشی از تحریمها و کمبود زیرساخت کارآزمایی بالینی روبرو است. این وضعیت یک سیستم دو لایه ایجاد میکند که در آن فناوریهای پیشرفته توسعهیافته داخلی ممکن است برای کاربردهای خاصی در دسترس باشند، اما دسترسی گستردهتر به درمانهای هدفمند و ایمونوتراپیهای جهانی و اغلب وارداتی، یک چالش مهم باقی میماند. این موضوع تعامل پیچیده سیاست ملی سلامت، عوامل اقتصادی و روابط بینالملل در ارائه مراقبتهای بهداشتی را برجسته میکند.
نقش تیمهای چندتخصصی (MDTs):
تیمهای چندتخصصی برای مراقبت جامع و شخصیسازی شده سرطان حیاتی هستند و همکاری بین انکولوژیستها، جراحان، رادیوانکولوژیستها، پاتولوژیستها، متخصصان مولکولی، پرستاران و سایر متخصصان را تقویت میکنند. مدیریت مبتنی بر MDT پایبندی به دستورالعملهای بالینی را افزایش میدهد، فاصله تشخیص تا درمان را کوتاه میکند و بقا و کیفیت زندگی را بهبود میبخشد، به ویژه برای سرطان ریه پیشرفته. در ایران، ۷۵٪ از پزشکان مورد بررسی گزارش دادند که MDT دارند، اما ۲۳٪ کمتر از یک بار در ماه جلسه داشتند ، که نشاندهنده یک شکاف بالقوه در اجرای مداوم است.
این وضعیت نشان میدهد که صرفاً ایجاد تیمهای چندتخصصی کافی نیست؛ عملکرد مداوم و مؤثر کلید موفقیت است. جلسات نامنظم میتواند مزایای تصمیمگیری مشارکتی را تضعیف کند و به طور بالقوه منجر به برنامههای درمانی نامناسب یا تأخیری شود، به ویژه در یک بیماری پیچیده مانند سرطان ریه که مسیرهای درمانی آن بر اساس پروفایلهای مولکولی به شدت فردیسازی شدهاند. این موضوع به نیاز به بهبودهای عملیاتی و تخصیص منابع برای حمایت از فعالیتهای منظم MDT اشاره دارد.
۷. پیشگیری و چشمانداز آینده سرطان ریه
راهبردهای پیشگیری اولیه
کنترل دخانیات: مؤثرترین راهبرد پیشگیری، ترک سیگار یا هرگز شروع نکردن آن است. ترک سیگار مزایای فوری برای سلامتی دارد. کمپینهای ضد دخانیات و آموزش در مورد عوامل خطر حیاتی هستند. اجرای مالیاتهای بالاتر بر سیگار میتواند به طور قابل توجهی مصرف و نرخ رشد سرطان ریه را کاهش دهد.
حفاظت از محیط زیست: محدود کردن مواجهه با رادون و کاهش آلودگی هوا بسیار مهم است.
عوامل سبک زندگی: حفظ وزن سالم از طریق ورزش و رژیم غذایی متعادل به کاهش خطر سرطان کمک میکند.
تحقیقات جاری و کارآزماییهای بالینی (جهانی و ایران)
تحقیقات تشخیص زودهنگام: تجزیه و تحلیل نمونههای خون (بیوپسیهای مایع) و خلط برای یافتن سلولهای تومور یا نشانگرهای مولکولی برای کمک به تشخیص زودهنگام.
پیشرفتهای درمانی:
توسعه مداوم درمانهای هدفمند برای جهشهای ژنتیکی جدید (مانند رپوترکتینیب برای فیوژنهای ROS1، سلپرکاتینیب برای جهشهای RET).
ادغام و بهینهسازی بیشتر ایمونوتراپی، از جمله درمانهای ترکیبی (مانند نیوولوماب/پمبرولیزوماب با شیمیدرمانی در تنظیمات نئوادجوانت/ادجوانت).
تحقیقات برای غلبه بر مقاومت به ایمونوتراپی در گروههای خاصی از بیماران (مانند NSCLC با جهش EGFR).
کارآزماییهای بالینی برای داروهای جدید مانند RMC-6236 که جهشهای خاص RAS را در تومورهای جامد پیشرفته هدف قرار میدهند.
نوآوریهای تکنولوژیک: یادگیری ماشین برای بهبود تجزیه و تحلیل سیتی اسکن.
تحقیقات در ایران:
وابستگیها در ایران درگیر تحقیقات راهبردهای واکسن سرطان ریه هستند (اگرچه راهبردهای خاص در این منابع جزئیات داده نشدهاند).
کارآزماییهای بالینی برای درمان با سلولهای T CAR برای سرطانهای کودکان در ایران در حال انجام است.
نیاز به مطالعات بالینی و اپیدمیولوژیک اضافی برای تعیین تأثیر عوامل غیرسیگار (محیطی، ژنتیکی) بر توسعه سرطان ریه در ایران برجسته شده است.
اهمیت سیاستهای بهداشتی و آگاهی عمومی
برنامهریزی جامع ملی برای از بین بردن عوامل خطر اصلی مورد نیاز است. برنامههای آموزشی، بهبود فرهنگی و روشهای تشخیصی جدید برای کاهش نرخ استاندارد شده سنی شیوع مفید هستند. رسانهها، مؤسسات آموزشی، مراکز بهداشتی و خانوادهها باید برای افزایش آگاهی و حمایت از افراد مبتلا همکاری کنند. یک سیستم سازمانیافته برای جمعآوری دادههای سرطان برای تعیین دقیق شیوع و روندها در ایران مورد نیاز است.
افزایش شیوع سرطان ریه در ایران و پیشبینی دو برابر شدن موارد سرطان به دلیل تغییرات جمعیتی و عوامل محیطی ، یک چالش مهم بهداشت عمومی در آینده را برجسته میکند. با این حال، ارتباط قوی بین سرطان ریه و عوامل خطر قابل تغییر مانند سیگار کشیدن (از جمله قلیان) و آلودگی هوا به این معنی است که بخش قابل توجهی از این بار آینده قابل پیشگیری است. مالیات پایین بر سیگار در ایران یک فرصت سیاستی روشن را ارائه میدهد. مداخلات بهداشت عمومی فعال و جامع، از جمله سیاستهای قوی کنترل دخانیات (به ویژه هدف قرار دادن قلیان)، مقررات کیفیت هوا و کمپینهای گسترده آگاهی عمومی، نه تنها مفید بلکه برای کاهش یک بحران بهداشتی قریبالوقوع در ایران ضروری هستند. این امر نیازمند اراده قوی سیاسی و همکاری چندبخشی است.
چندین منبع به “کمبود داده از ایران در مورد عوامل خطر سرطان ریه” و نیاز به “سیستم سازمانیافته برای جمعآوری دادههای سرطان” و “مطالعات بالینی و اپیدمیولوژیک اضافی” اشاره میکنند. این یک موضوع اساسی و مهم است. بدون دادههای قوی و جامع محلی، ارزیابی دقیق چشمانداز اپیدمیولوژیک، شناسایی عوامل خطر منطقهای خاص و ارزیابی اثربخشی مداخلات چالشبرانگیز است. این موضوع یک چالش اساسی برای سیاستگذاری مبتنی بر شواهد و تخصیص منابع در مبارزه ایران با سرطان ریه را برجسته میکند. سرمایهگذاری در ثبت ملی سرطان، تحقیقات اپیدمیولوژیک و مطالعات عوامل خطر محلی برای توسعه راهبردهای پیشگیری و کنترل مؤثر و متناسب بسیار مهم است.
۸. نتیجهگیری
سرطان ریه همچنان یک بار جهانی سنگین از نظر بیماری و مرگ و میر است که سالانه میلیونها نفر را تحت تأثیر قرار میدهد. در حالی که ایران در مقایسه با بسیاری از کشورهای غربی نرخ شیوع استاندارد شده سنی پایینتری دارد، اما با یک روند صعودی نگرانکننده در شیوع، بار مرگ و میر بالا نسبت به شیوع، و عوامل خطر محلی خاص مانند قلیان کشیدن و آلودگی هوا مواجه است. این وضعیت نشاندهنده یک مرحله نوظهور از اپیدمی سرطان ریه در کشور است که نیاز به اقدامات پیشگیرانه و درمانی فوری دارد.
پیشرفتهای علمی قابل توجهی در تشخیص سرطان ریه، از جمله روشهای تصویربرداری پیشرفته (LDCT، HRCT، MDCT)، بیوپسی مایع، هوش مصنوعی و توالییابی نسل بعدی، حاصل شده است. این نوآوریها امکان تشخیص زودهنگام و دقیقتر را فراهم میکنند. در حوزه درمان، علاوه بر روشهای سنتی مانند جراحی (با تکنیکهای کمتهاجمی مانند VATS)، رادیوتراپی و شیمیدرمانی، درمانهای پیشرفتهای نظیر درمانهای هدفمند (بر اساس جهشهای مولکولی مانند EGFR، ALK، ROS1) و ایمونوتراپی (با هدف قرار دادن مسیر PD-1/PD-L1) به طور چشمگیری نتایج بیماران را بهبود بخشیدهاند. ایران نیز در حال توسعه زیرساختهای درمانی پیشرفته و فناوریهای داخلی مانند الکتروشیمیدرمانی است که نشاندهنده تعهد به مراقبتهای مدرن سرطان است.
با این حال، چالشهای مهمی در مسیر دسترسی به این پیشرفتها وجود دارد. نرخهای بالای مثبت کاذب و تشخیص بیش از حد در برنامههای غربالگری، نیاز به انتخاب دقیق بیمار و پروتکلهای پیگیری قوی را ضروری میسازد. در ایران، دسترسی مشکلساز به تشخیصهای پیشرفته مولکولی، هزینههای بالای داروهای نوین، کمبود زیرساخت برای کارآزماییهای بالینی و موانع خارجی، شکاف قابل توجهی بین قابلیتهای درمانی موجود و دسترسی واقعی بیماران ایجاد میکند. علاوه بر این، در حالی که تیمهای چندتخصصی برای مراقبت جامع ضروری هستند، عملکرد ناسازگار آنها در برخی مناطق میتواند اثربخشی درمان را کاهش دهد.
برای کاهش بار جهانی و محلی سرطان ریه و بهبود کیفیت زندگی بیماران، راهبردهای جامع پیشگیری اولیه، به ویژه کنترل دقیق دخانیات (شامل قلیان)، کاهش آلودگی محیطی و ترویج سبک زندگی سالم، حیاتی هستند. ادامه تحقیقات برای تشخیص زودهنگام، توسعه درمانهای جدید و غلبه بر مقاومت دارویی ضروری است. در نهایت، جمعآوری دادههای قوی و سازمانیافته، سیاستگذاریهای بهداشتی هدفمند و همکاریهای ملی و بینالمللی برای اطمینان از دسترسی عادلانه به تشخیصها و درمانهای پیشرفته، و برای مقابله با چالشهای منحصر به فرد هر منطقه، از جمله ایران، ضروری است