مقدمه:
بیماری سلیاک دیگر یک اختلال گوارشی نادر در کودکان نیست. امروزه، پزشکان آن را یک بیماری خودایمنی سیستمیک و شایع میدانند. این بیماری در افراد با زمینه ژنتیکی خاص و در پاسخ به مصرف گلوتن فعال میشود. بیماری سلیاک میتواند در هر سنی خود را نشان دهد. بنابراین، درک عمیق علل، مکانیسمها و طیف گسترده علائم آن برای تشخیص و مدیریت درست، حیاتی است.
—
۱. اتیولوژی و زمینه ژنتیکی بیماری سلیاک
بیماری سلیاک حاصل تعامل سه عامل ژنتیک، گلوتن و محیط است.
۱.۱. استعداد ژنتیکی (HLA و ژنهای غیر-HLA)
تقریباً تمام مبتلایان به بیماری سلیاک، ژنهای خاصی از سیستم HLA را دارند. حدود ۹۵-۹۰ درصد آنان ژن HLA-DQ2 و بقیه معمولاً HLA-DQ8 را حمل میکنند. این مولکولها نقش کلیدی در بیماریزایی دارند. آنها پپتیدهای گلوتن را به سلولهای T سیستم ایمنی ارائه میدهند و پاسخ ایمنی را راه میاندازند.
با این حال،داشتن این ژنها به تنهایی برای ابتلا کافی نیست. تنها حدود ۱ درصد از حاملان این ژنها به بیماری سلیاک مبتلا میشوند. این موضوع نقش ژنهای غیر-HLA و عوامل محیطی دیگر را پررنگ میکند.
۱.۲. نقش گلوتن و دِآمیداسیون
گلوتن پروتئین موجود در گندم، جو و چاودار است. بخش محرک اصلی آن، گلیادین نام دارد. گلیادین سرشار از اسیدهای آمینه پرولین و گلوتامین است. آنزیمهای روده انسان به سختی میتوانند آن را کاملاً هضم کنند.
پپتیدهای هضمنشده گلیادین به لایه زیرین مخاط روده نفوذ میکنند.در آنجا، آنزیم ترانس گلوتامیناز بافتی (tTG)، این پپتیدها را تغییر میدهد. این فرآیند “دِآمیداسیون” نام دارد. پپتیدهای دِآمیده شده، با قدرت بیشتری به مولکولهای HLA-DQ2/DQ8 متصل میشوند. این اتصال محکم، پاسخ ایمنی را به شدت فعال میکند.
۲. پاتوفیزیولوژی پیچیده: پاسخ ایمنی در سلیاک
پاتوفیزیولوژی بیماری سلیاک دو مرحله اصلی دارد: ایمنی ذاتی و ایمنی اکتسابی.
۲.۱. اختلال در سد روده و ایمنی ذاتی
در مرحله اول، سد روده نفوذپذیر میشود. تحقیقات نشان میدهند گلوتن ممکن است ترشح “زونولین” را افزایش دهد. زونولین اتصالات بین سلولهای روده را شل میکند. در نتیجه، پپتیدهای گلوتن به راحتی به لایههای عمقیتر روده راه مییابند و یک التهاب اولیه ایجاد میکنند.
۲.۲. فعالسازی ایمنی تطبیقی (نقش کلیدی T سلها)
این مرحله، قلب واکنش خودایمنی در بیماری سلیاک است.
سلولهای عرضهکننده آنتیژن،پپتیدهای دِآمیده شده گلوتن را به سلولهای T کمکی نشان میدهند. این نمایش توسط مولکولهای HLA-DQ2/DQ8 انجام میشود.
سلولهای T فعال شده،تکثیر میشوند و سیتوکینهای التهابی قوی مانند interferon-gamma ترشح میکنند. این مواد مستقیماً به پرزهای روده آسیب میرسانند.
همچنین،سلولهای B نیز تحریک میشوند و آنتیبادیهای خودایمنی تولید میکنند. مهمترین این آنتیبادیها عبارتند از:
· آنتیبادی ضد ترانس گلوتامیناز بافتی (IgA-tTG)
· آنتیبادی ضد اندومیزیوم (IgA-EmA)
۳. آسیبشناسی و تظاهرات بالینی
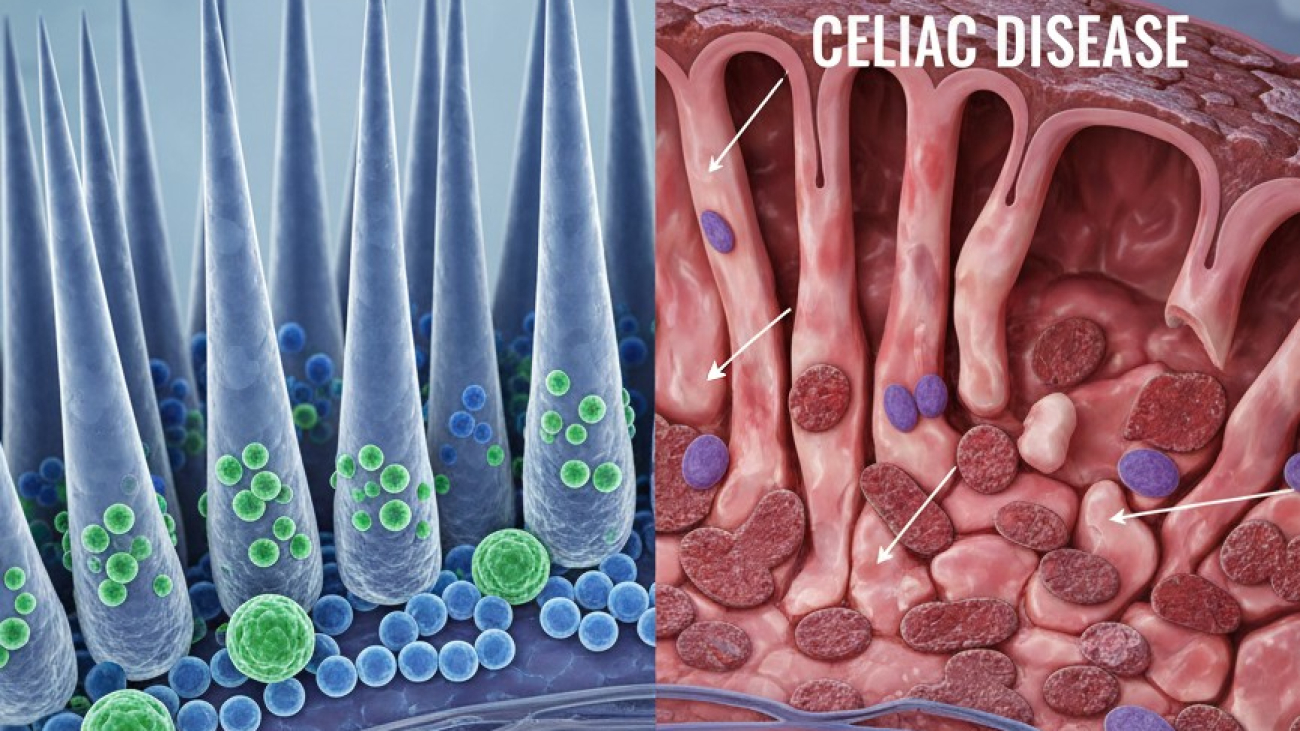
۳.۱. آنتروپاتی سلیاک (آسیب بافتی روده)
آسیب به روده کوچک مشخصه اصلی بیماری سلیاک فعال است. این آسیب سه ویژگی دارد:
· آتروفی پرزها: پرزهای روده تحلیل میروند و سطح جذب شدیداً کاهش مییابد.
· هیپرپلازی کریپتها: cryptهای روده برای جبران آسیب، عمیقتر میشوند.
· افزایش لنفوسیتهای داخل اپیتلیالی: سلولهای التهابی به داخل پوشش روده نفوذ میکنند.
پزشکان شدت این آسیبها را با سیستم درجهبندی”مارش” طبقهبندی میکنند.
۳.۲. طیف علائم: از گوارشی تا سیستمیک
بیماری سلیاک تظاهرات بسیار متنوعی دارد.
الف. تظاهرات کلاسیک (گوارشی):
این علائم معمولاً در کودکان دیده میشوند:
· اسهال مزمن
· نفخ و درد شکم
· کاهش وزن یا اختلال رشد
ب. تظاهرات غیرکلاسیک (خارج رودهای):
این علائم در بزرگسالان شایعتر است و نشان از سیستمیک بودنبیماری سلیاک دارد:
· کمخونی فقر آهن مقاوم به درمان
· پوکی استخوان زودرس
· درماتیت هرپتیفرمیس (بثورات پوستی تاولدار)
· علائم عصبی مانند آتاکسی و نوروپاتی
· اختلالات کبدی و باروری
۴. تشخیص و چالشها
تشخیص بیماری سلیاک مانند چیدن یک پازل است.
۴.۱. غربالگری سرولوژیک
این تستها اولین قدم هستند:
· آنتیبادی IgA ضد tTG: تست غربالگری اولیه و رایج.
· آنتیبادی IgA ضد اندومیزیوم: تستی با اختصاصیت بسیار بالا.
نکته مهم:بیمار باید قبل از آزمایش، رژیم حاوی گلوتن داشته باشد تا نتیجه تست منفی کاذب نشود.
۴.۲. تایید تشخیصی: آندوسکوپی و بیوپسی
برای تشخیص قطعی، پزشک آندوسکوپی فوقانی انجام میدهد. او از دوازدهه نمونهبرداری (بیوپسی) میکند. پاتولوژیست نمونه را زیر میکروسکوپ بررسی میکند تا آسیب مشخصه بیماری سلیاک را پیدا کند.
۵. مدیریت و رویکردهای درمانی نوین
۵.۱. رژیم غذایی سخت و مادامالعمر بدون گلوتن (GFD)
این رژیم، تنها درمان مؤثر بیماری سلیاک است. حذف کامل گلوتن منجر به:
· بهبودی علائم
· ترمیم تدریجی پرزهای روده
· کاهش سطح آنتیبادیها در خون
میشود.حتی مقادیر بسیار کم گلوتن نیز میتواند آسیبرسان باشد.
۵.۲. درمانهای حمایتی
بسیاری از بیماران به دلیل سوء جذب، نیاز به مکمل دارند:
· آهن و اسید فولیک برای کمخونی
· کلسیم و ویتامین D برای سلامت استخوان
۵.۳. چشمانداز آینده: درمانهای غیر-GFD
تحقیقات برای یافتن درمانهای جدید بسیار فعال است:
· آنزیمدرمانی خوراکی: آنزیمهایی که پپتیدهای گلوتن را در روده خنثی میکنند.
· درمانهای مبتنی بر سد روده: داروهایی که نفوذپذیری روده را کاهش میدهند.
· واکسنها و ایمونوتراپی: آموزش مجدد سیستم ایمنی برای تحمل گلوتن.
۶. عوارض و پیشآگهی
در صورت تشخیص زودهنگام و رعایت رژیم بدون گلوتن، پیشآگهی بیماری سلیاک عالی است. اما عدم درمان میتواند منجر به عوارض جدی مانند سوءتغذیه، پوکی استخوان شدید و افزایش خطر برخی سرطانهای نادر روده شود.
نتیجهگیری
بیماری سلیاک یک بیماری خودایمنی پیچیده با پایه ژنتیکی قوی است. این بیماری از یک اختلال گوارشی ساده فراتر رفته و یک بیماری سیستمیک با علائم گسترده است. اگرچه رژیم سخت بدون گلوتن تنها درمان فعلی است، اما پژوهشهای امیدوارکنندهای برای توسعه درمانهای دارویی جدید در جریان است. این درمانها آینده بهتری برای کیفیت زندگی بیماران مبتلا به بیماری سلیاک نوید میدهند.